Other Languages Available:
English
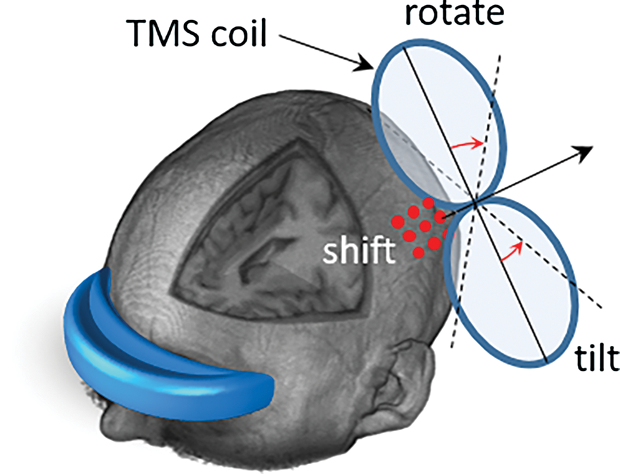
A common application for brain stimulation is surgery planning used to identify brain regions before or during resection [1]. In addition, noninvasive brain stimulation has been becoming a common clinical procedure with several applications in the therapy of depression, brain mapping, and rehabilitation. It is typically conducted by generating an electric field in the brain with several coil or electrode designs tailored to application purposes. A widely used method is transcranial magnetic stimulation (TMS), where a figure-eight coil is located close to the scalp to generate impulsive internal electric field resulting in the stimulation for interrupting patient’s electrophysiological responses according to the target brain region (e.g., finger motion or speech interruption when targeting the hand motor area or Broca’s area, respectively). Then, by observing patient behavior, the coil position is registered when a response is observed, and the target area is identified using anatomical images such as magnetic resonance imaging (MRI). This process is important and requires careful consideration for accurate annotation of brain regions. As the electric field distribution is highly sensitive to inter- and intra-variabilities in patient anatomy, performing computer simulation using the exact patient anatomy (commonly based on MRI) and coil positioning to identify the distribution map of the electrical field in the brain is required in the future for better understanding of the brain mapping. However, the process is time-consuming and requires several hours in the current clinical paradigm. As shown in Figure 1, several parameters to be considered in the computations such as coil location (red dots on the surface of the scalp), injection current, and coil orientation in the 3-D space (rotation and tilting). Several studies are performed to understand how these parameters are related to the distribution of the induced electric field in different brain regions [2].
To clearly demonstrate challenges related to this simulation, we can think of the following standard pipeline. First, the subject needs to undergo an MRI scan that demonstrates the anatomical structures of the head. Then, a model is constructed from the MRI data using segmentation of different tissues and fluids. The segmentation process here is rather complicated as it should include identification of all head structures, not only the brain components. This is quite challenging especially for head tissues appearing in low-contrast and/or small regions in standard clinical MRI. Every head tissue is assumed to have an isotropic conductivity value (which is not realistic but represents a good approximation), and a volume conductor model can be used to simulate the electric current distribution within the brain (and other surrounding tissues as well). Simulation is performed iteratively, and thus it is computationally rich. Moreover, simulation can be repeated several times with different coil positions to optimize the location of electric-field hot spot on the target brain region.
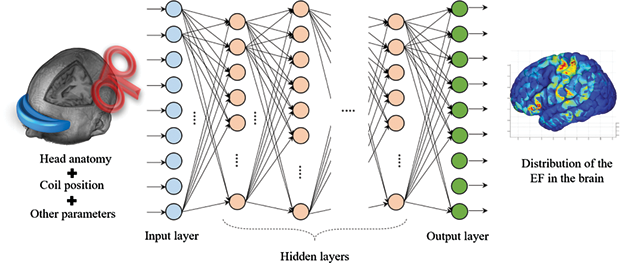
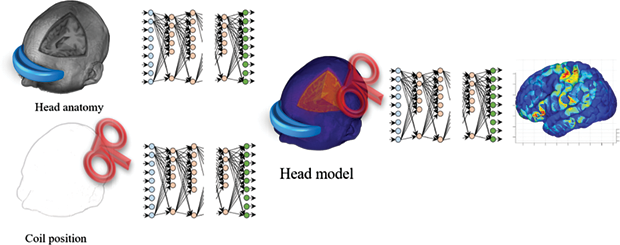
The technology known as deep learning has been shown to perform within human-like proficiency in several challenging applications. AlphaGo was the first computer program that used deep learning to achieve superior performance in the strategic game Go [3]. This performance attracted the attention of a new generation to artificial intelligence (AI) that can provide solutions to highly complicated problems. Deep learning is now a common approach in several applications such as image segmentation, computer vision, bioinformatics, drug discovery, etc. It therefore became interesting to study how deep learning can be employed for solving brain stimulation problems. One potential approach (Figure 2) is to map the head anatomy (such as MRI) and coil position to the electric field distribution in the brain [4]. This approach can generate a potential distribution of the electric field within a relatively short time with high accuracy, which is convenient for clinical applications. However, it needs a very long time to train, considering several variations of the head anatomy (different subjects) and the coil positions (several coil setups within each subject). Another approach (Figure 3) is to split this complicated process into smaller problems and solve each using deep learning [5]. In this approach, automatic generation of a head model from MRI can be achieved, therefore each voxel can be easily assigned to specific tissue with known electric conductivity value. In the same way, the coil position can be mapped using a separate network. Finally, the head model and coil position can be fused to extract the electric field distribution in the brain.
The use of deep learning in the analysis of the interaction between electromagnetic fields and biological tissues is an emerging research field. Several questions are still open, and standard techniques are not yet available. Several network architectures are recently proposed, but more efforts are still required with the wide band of potentials offered by deep learning. Understanding the blend of electric field and biological tissues not only leads to better understanding of medical applications, but may also lead to new horizons of better health care service. The human brain is a mysterious, fantastic organ with unbounded abilities that is known to be unreproducible with all technology innovations available today and in the near future. However, a new generation of AI can lead future research to a new scale that was very difficult to achieve in the past. Human-level thinking and top-level reasoning can lead to solve highly complicated problems and help provide a better life, especially in the field of health care.
See References
Español
Cerebro IA: Aprendizaje profundo para Estimulación Cerebral
Una aplicación de la estimulación cerebral es identificar regiones del cerebro el antes o durante la cirugía del tumor cerebral [1]. Además, estimulación no invasiva del cerebro es un procedimiento común en la práctica clínica con diferentes aplicaciones en la terapia, planeamiento y rehabilitación. Estimulación del cerebro se lleva a cabo a partir de un campo eléctrico inducido por bovinas diseñados para estos propósitos. Para ese fin, estimulación magnética transcraneana es un método que genera o interrumpe funciones cerebrales por medio de una bovina localizada cercana al cráneo (por ejemplo, las respuestas que se pueden generar son el movimiento de un dedo o interrumpir el habla por estimulación dirigida a zonas específicas del cerebro). Estas respuestas se usan para determinar qué zonas cerebrales son estimuladas para crear un mapa de funciones del cerebro. Para determinar las zonas que se están estimulando, simulaciones del campo magnético en el cerebro se llevan a cabo usando modelos anatómicamente idénticos de los pacientes obtenidos a partir de imagen por resonancia magnética (IRM). El proceso de crear los modelos anatómicos puede durar horas. En la figura 1 se muestran los parámetros que se consideran en las simulaciones: posición de la bovina (puntos rojos en la cabeza) y orientación en el espacio tridimensional. Diferentes reportes se han llevado a cabo para entender cómo estos parámetros son relacionados con la distribución del campo eléctrico en las diferentes zonas del cerebro [2].

Para ejemplificar los desafíos de las simulaciones, podemos considerar el procedimiento típico que se sigue. Primero, se escanea la cabeza del paciente para determinar las estructuras anatómicas por medio de IRM. Luego un modelo anatómico de la cabeza es creado a partir de la segmentación de IRM. La segmentación es un proceso complicado y todas las estructuras se deben identificar (no solamente el cerebro). La segmentación es difícil debido al bajo contraste y existencia de regiones pequeñas. El valor de la conductividad de cada tejido de la cabeza se asume isotrópico (no realístico pero una buena aproximación) y un modelo conductor se usa para calcular la distribución del campo eléctrico en el cerebro y otros tejidos. La simulación es computacionalmente costosa. Además, se debe repetir varias veces con diferentes posiciones de las bovinas para optimizar la localización del punto focal del campo eléctrico en el cerebro.

Una tecnología emergente, llamada aprendizaje profundo, ha podido realizar tareas sofisticadas y complejas con competencia humana. AlphaGo fue el primer programa computacional que usó aprendizaje profundo para alcanzar un desempeño superior en el juego estratégico de Go [3]. Este desempeño atrajo la atención de una nueva generación de inteligencia artificial (IA) que generó soluciones a problemas con alto grado de complejidad. En la actualidad, aprendizaje profundo es una solución común en aplicaciones de segmentación de imágenes, visión por computador, bioinformática, descubrimiento de farmacéuticos, etc. Es interesante investigar cómo se puede aplicar al tema de la estimulación cerebral. Un posible abordaje (figura 2) es un mapeo de la anatomía de la cabeza (por medio de IRM) y la posición de las bovinas a la distribución del campo eléctrico en el cerebro [4]. Este procedimiento puede obtener el campo eléctrico en un tiempo relativamente corto y con gran precisión para aplicaciones clínicas. Sin embargo, se necesita un tiempo significativo de entrenamiento para considerar muchas variantes de la anatomía de la cabeza (diferentes pacientes) y posiciones de la bovina usadas en una típica sesión clínica. Otra posibilidad, es separar este complejo proceso en pequeños problemas y resolver cada uno por aprendizaje profundo [5]. En este abordaje, la generación automática de un modelo de la cabeza del paciente a partir de IRM se puede alcanzar, de manera que, se pueda asignar un valor de conductividad eléctrica a cada elemento o vóxel del modelo. De la misma forma, la posición de la bovina se pueda mapear usando una red neuronal adicional. Finalmente, el modelo de la cabeza y la posición de la bovina se pueden combinar para extraer el campo eléctrico en el cerebro.

El uso de aprendizaje profundo en el análisis de la interacción de los campos eléctricos y los tejidos biológicos es un nuevo campo de investigación. Muchas preguntas están pendientes por ser resueltas y nuevas técnicas por ser desarrolladas. Diferentes estructuras de las redes se han propuesto recientemente, pero más investigación se requiere considerando el rango de aplicaciones que ofrece el aprendizaje profundo. Entendiendo las relaciones entre los campos eléctricos y los tejidos biológicos no solo ayudarían a las aplicaciones médicas, pero también abrir nuevas fronteras en el servicio médico.
El cerebro humado es un órgano fantástico con habilidades ilimitadas que no se pueden reproducir con la tecnología actual y avances en un futuro cercano. Sin embargo, la nueva generación de IA puede guiar la investigación futura para alcanzar nuevas escalas. Tecnologías con pensamiento y razonamiento a nivel humado puede llevar a resolver problemas con un alto nivel de dificultad y alcanzar una vida mejor con mejores herramientas en el área de la asistencia médica.
Bibliografía
日本語
Brain AI:脳刺激のための深層学習
脳刺激の一般的な用途は、切除前もしくは切除中の脳機能領域特定のために用いられる診断である[1]。加えて、非侵襲的脳刺激は、鬱病の治療、、脳機能マッピング、リハビリテーションなどにおいて一般的な臨床的プロセスになりつつある。通常、用途に合わせた複数のコイル、あるいは電極を用いて脳内に電場を発生させることによって刺激を実現する。広く用いられている手法として、経頭蓋磁気刺激(TMS)があげられる。TMSとは、インパルス性の内部電界を生成するために頭蓋の近くに8の字型コイルを配置し、対象とする脳領域に応じて患者の電気生理応答を生成または遮断する刺激法である(一次運動野、Broca野をそれぞれターゲットにしているときの指の動き、発話の中断など)。刺激時に患者の行動を観察することによって、応答が観察されたときにコイル位置を記録、磁気共鳴画像法(MRI)などの解剖学的画像を用いて標的領域が識別される。このプロセスは重要であり、脳領域の正確な診断については詳細な検討が必要である。電場分布は患者内もしくは患者間の解剖学的構造により非常にばらつくため、(通常MRIに基づく)患者の正確な解剖学的構造とコイル位置に基づき、脳内の電界分布を特定するための計算技術が、将来の脳機能マッピングの高度化に必要とされている。しかしながら、このプロセスは時間がかかり、現在の臨床的パラダイムでは数時間以上を要する。図1に示すように、コイル位置(頭皮の場合は表面上の赤い点)、注入電流、および3D空間におけるコイル方向(回転および傾斜)などの計算において考慮すべきパラメータがある。これらのパラメータが異なる脳領域における誘導電界分布にどのように関連しているかを理解するためにいくつかの研究が行われている[2]。

この一連の計算に関する課題を明確に説明するために、標準的なパイプラインを考える。まず、被験者は頭部の解剖学的構造を示すMRIスキャンを受ける必要がある。次に、異なる組織および体液のセグメンテーションを用いてMRIデータから詳細な人体モデルを構築する。ここでのセグメンテーション手順は、脳の構成要素だけでなく、すべての頭部組織を識別する必要があるため、かなり複雑である。特に標準的な臨床MRIの低コントラスト領域および小さな領域に見られる頭部組織に関しては非常に困難である。すべての頭部組織は等方性導電率(現実的ではないものの、良好な近似を表す)を有すると仮定し、ボリュームコンダクターモデルを使用して脳内(および他の周辺組織)の電流分布を計算することができる。シミュレーションは繰り返し実行されるため、計算量は多くなる。さらに、標準的脳領域の電界ホットスポットを最適化するために、異なるコイル位置でシミュレーションを数回繰り返すことが必要になる場合がある。

ディープラーニングとして知られる技術は、困難な応用において人間のような習熟度の範囲内で機能することが示されている。AlphaGoは戦略的なゲームである囲碁で優れたパフォーマンスを発揮するためにディープラーニングを使用した最初のコンピュータプログラムであった[3]。このパフォーマンスは、非常に複雑な問題に対する解決策を提供することができる人工知能(AI)に対して新しい世代の注目を集めた。ディープラーニングは、現在、画像セグメンテーション、コンピュータビジョン、生命情報科学、創薬などの分野で一般的なアプローチとなっている。したがって、脳刺激の問題を解決するためにどのようにディープラーニングを利用するかを研究することは興味深いものとなった。1つの有望な手法(図2)は、頭部の(MRIなどの)解剖学的構造とコイル位置を脳内の電界分布にマッピングすることだ[4]。この手法は、比較的短時間に高精度で電界のポテンシャル分布を生成することができ、臨床応用に有用である。しかし、頭部の(異なる被験者の)解剖学的構造およびコイル位置(各被験者内のいくつかのコイル配置)のいくつかのバリエーションを考慮すると、学習するのに非常に長い時間が必要となる。もう1つの手法は、この複雑なプロセスを小さな問題に分割し、ディープラーニングを使用してそれぞれの問題を解決することである[5]。この手法では、MRIから頭部モデルの自動生成を実現することができ、したがって、各ボクセルを既知の電気導電率を有する特定の組織に容易に割り当てることができる。 同様に、コイル位置は別のネットワークを用いてマッピングすることができる。最後に、頭部モデルとコイル位置を合わせることで脳内電界分布を取り出すことができる。

電磁界と生体組織との相互作用の分析に対するディープラーニングの応用は、新たな研究分野である。いくつかの問題が未解決であり、標準的な手法はまだ確立されていない。最近いくつかのネットワークアーキテクチャが提案されているが、ディープラーニングによってもたらされる広範囲の可能性に対しては更なる工夫が必要である。電界と生体組織の相互作用を理解することは、医療応用の更なる理解につながるだけでなく、より良いヘルスケアサービスに対する新たな展望へとつながるであろう。人間の脳は、今日、さらには近い将来、利用可能なすべての技術革新で再現不可能であると知られている、無限の性能を持つ神秘的で素晴らしい器官である。しかし、新世代のAIは今後の研究を、今まで達成することが非常に困難だった新しいスケールに導くことができる。人間レベルの思考とトップレベルの推論は、ヘルスケアの分野において、非常に複雑な問題を解決し、より良い生活を送るのに役立つだろう。
References/Bibliography
- T. Picht et al., “Preoperative functional mapping for rolandic brain tumor surgery: Comparison of navigated transcranial magnetic stimulation to direct cortical stimulation,” Neurosurgery, vol. 69, pp. 581–589, 2011.
- J. Gomez-Tames et al., “Atlas of optimal coil orientation and position for TMS: A computational study,” Brain Stimul., vol. 11, pp. 839–848, 2018.
- D. Silver et al., “Mastering the game of Go without human knowledge,” Nature, vol. 550, pp. 354–359, 2017.
- T. Yokota et al., “Real-time estimation of electric fields induced by transcranial magnetic stimulation with deep neural networks,” Brain Stimul., in press (DOI: 10.1016/j.brs.2019.06.015).
- E. A. Rashed et al., “Development of accurate human head models for personalized dosimetry using deep learning,” NeuroImage, to be published.



